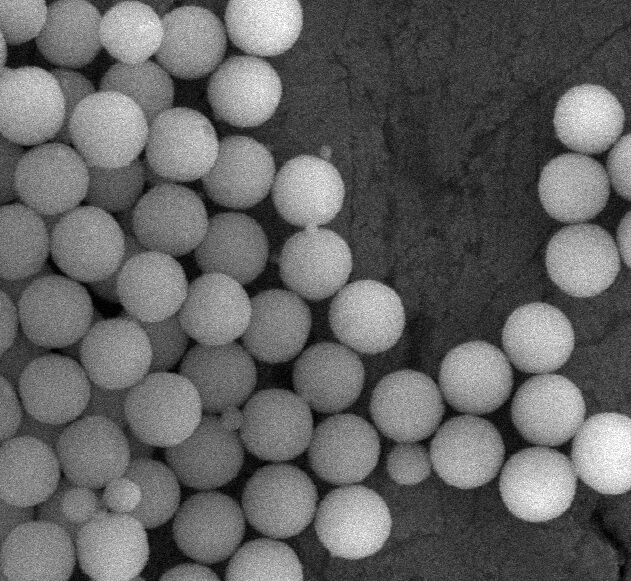
A Sílica, também conhecida como dióxido de silicone, é um mineral composto de silício e oxigénio e é utilizada em cosméticos, especialmente em produtos de maquilhagem. O tipo de Sílica utilizada nesses produtos é a sílica amorfa, ou seja, não possui um arranjo específico dos átomos e, consequentemente, não possui uma forma definida. A Sílica (forma amorfa) também é usada como aditivo alimentar na União Europeia (UE) e nos Estados Unidos (aprovada nos EUA pela Food and Drug Administration (FDA)). Produtos relacionados com a sílica, como sílica hidratada, metassilicato de alumina e magnésio, silicato de alumínio e cálcio e sódio, silicatos de alumínio e ferro e silicato de sódio e potássio de alumínio, também são usados como ingredientes cosméticos na UE.
De acordo com o Regulamento (CE) No. 1223/2009 relativo aos produtos cosméticos, um ‘nanomaterial’ é descrito como “um material insolúvel ou biopersistente, fabricado intencionalmente e dotadeo de uma ou mais dimensões externas ou de uma estrutura interna, numa escala de 1 a 100 nm”. Os produtos cosméticos que contenham ‘nanomateriais’ estão sujeitos a uma notificação específica à Comissão Europeia e a Pessoa Responsável deve notificá-lo por via eletrónica seis meses antes da sua colocação no mercado.
O Comité Científico para a Segurança do Consumidor da Comissão Europeia (SCCS – Scientific Committee of Consumer Safety) emitiu uma opinião sobre a Sílica (Sílica Amorfa Sintética – SAS) e a sua solubilidade e consequente classificação como nanomaterial. O SCCS afirmou que, de acordo com a definição de nanomaterial pelo Regulamento Europeu de Cosméticos, nenhum dos materiais SAS (hidrofóbico ou hidrofílico) incluidos no dossiê pode ser considerado solúvel. Isto significa que o SCCS considerou que a Sílica é insolúvel e, se mais de 50% de suas partículas tiverem tamanho inferior a 100 nanometros, pode ser classificada como nanomaterial. O presente parecer aplica-se à Sílica e aos materiais relacionados (Hydrated Silica, Silica Dimethyl Silylate, Silica Silylate, Silica Dimethicone Silylate, Silica Caprylyl Silylate and, Silica Cetyl Silylate).
A Associação de Produtores de Sílica Amorfa Sintética (ASASP – Association of Synthetic Amorphous Silica Producers) é composta por 9 membros que representam a maioria dos produtores de SAS na Europa e considera que o SAS é solúvel e, por isso, não deve ser considerado um nanomaterial.
No entanto, os fornecedores de matérias-primas que contenham Sílica devem fornecer documentação sobre a distribuição do tamanho de partícula no ingrediente, para confirmar se o tamanho da partícula está abaixo do limite máximo (cut-off) e se, consequentemente, precisa ser considerado como a forma nano (de acordo com a opinião do SCCS).
Se um produto cosmético tiver na sua consituição Sílica na forma nano (ou outro ingrediente nesta forma), deve ser claramente indicado na lista de ingredientes presente na rotulagem do produto. A palavra «nano» entre parêntesis deve figurar a seguir aos nomes (por exemplo, sílica [NANO]).
O SCCS emitiu um parecer científico sobre a segurança dos nanomateriais em cosméticos. O Comitê identificou alguns aspectos dos nanomateriais que constituem uma base para a preocupação relativamente à segurança para a saúde dos consumidores quando usados em cosméticos, incluindo aspectos físico-químicos (por exemplo, dimensões muito pequenas de partículas), aspectos de exposição (por exemplo, frequência e quantidades aplicadas, potencial de exposição sistêmica e acumulação no corpo) e outros aspectos (como novas propriedades). Essas preocupações foram detalhadas no documento em três anexos separados.
Com o desenvolvimento do conhecimento científico e com a contínua investigação, os nanomateriais estão sendo cada vez mais usados em cosméticos. No entanto, deve-se ter cuidado, pois há certos aspectos destes ingredientes que ainda não são totalmente conhecidos e que podem representar uma preocupação de segurança.
Referências:
- European Food Safety Authority – Re-evaluation of Silicon Dioxide (E 551) as a food additive. Available at: https://efsa.onlinelibrary.wiley.com/doi/10.2903/j.efsa.2018.5088
- Regulation (EC) No 1223/2009 of the European Parliament and of the Council of 30 November 2009 on cosmetic products. Available at: https://ec.europa.eu/health/sites/health/files/endocrine_disruptors/docs/cosmetic_1223_2009_regulation_en.pdf
- Scientific Committee on Consumer Safety (SCCS). Opinion on solubility of Synthetic Amorphous Silica (SAS). SCCS/1606/19. Available at: https://ec.europa.eu/health/sites/health/files/scientific_committees/consumer_safety/docs/sccs_o_228.pdf
- Synthetic Amorphous Silica (SAS) industry response to the opinion of the Scientific Committee on Consumer Safety (SCCS) on silica in cosmetics with regard to solubility. Available at: https://www.asasp.eu/images/Publications/ASASP1101b_-_ASASP_response_to_solubility_SCCS_Opinion_Dec_2019_final.pdf
- Scientific Committee on Consumer Safety (SCCS). Scientific Advice on the safety of nanomaterials in cosmetics (SCCS/1618/20). Available at: https://ec.europa.eu/health/sites/health/files/scientific_committees/consumer_safety/docs/sccs_o_239.pdf