ITÁLIA – DECRETO LEGISLATIVO Nº. 116
O Decreto Legislativo Italiano N.º 152 de abril de 2006 foi alterado pelo Decreto Legislativo N.º 116 de 3 de setembro de 2020. Este Decreto apresentou novos requisitos relativos à informação sobre eliminação que deve ser indicada na rotulagem dos produtos (incluindo produtos cosméticos e de cuidados pessoais, dispositivos médicos e suplementos alimentares). (mais informação em publicação anterior)
O Decreto Legislativo nº 116 estabelece que é obrigatório indicar claramente na rotulagem as seguintes informações:
– A natureza dos materiais de embalagem utilizados, indicando o código alfanumérico de acordo com a Decisão 97/129/CE
- Aplicável às embalagens destinadas à atividade profissional (circuito B2B) e ao consumidor final (circuito B2C)
– Indicações relativas à recolha seletiva, reutilização,recuperação e reciclagem e informações corretas aos consumidores sobre o destino final das embalagens.
- Aplicável às embalagens fornecida ao consumidor final (circuito B2C)
Esta informação deve ser apresentado em italiano.
A CONAI (consórcio privado nacional de embalagens) e o Instituto Italiano de Embalagens emitiram Guidelines sobre a rotulagem ambiental. Estas Guidelines incluem a sugestão de alguns exemplos de rotulagem ambiental para ajudar as empresas a cumprir com o disposto no Decreto.

A obrigação de cumprimento com a rotulagem ambiental em Itália é aplicável desde 1 de Janeiro de 2023. As embalagens que já tenham sido disponibilizadas no mercado Italiano antes de 1 de janeiro de 2023 podem ser comercializadas até escoar o stock.
FRANÇA – LEI ANTI-RESÍDUOS
A Lei Anti-Resíduos francesa, também chamada de lei AGEC (Loi relative à la lute contre le gaspillage et a l’économie circulaire), contém cerca de 50 medidas que incluem novas obrigações (exigência de transparência), novas proibições (controlo de ambições ecológicas irreversíveis) e novas ferramentas para controlar melhor e sancionar infrações contra o meio ambiente. (mais informação em publicação anterior)
Os produtos cosméticos que são disponibilizados no mercado francês também têm que cumprir a lei anti-resíduos.
O CITEO (programa francês de recuperação de embalagens) divulgou uma guideline sobre informações de descarte. O objetivo é ajudar os produtores a ajustar a rotulagem das embalagens de forma a estar em conformidade com a legislação francesa.
Desde Janeiro de 2022, o Logo Triman (logotipo) é obrigatório e deve ser indicado no produto, na sua embalagem ou na documentação fornecida com o produto. Esta obrigação legal também é aplicável aos produtos vendidos online para França. Deve ser acompanhado das informações sobre o processo de triagem/separação para cada tipo de produto. Quaisquer outros sinais que possam confundir os consumidores em relação às regras de classificação devem ser removidos. (mais informação em publicação anterior)
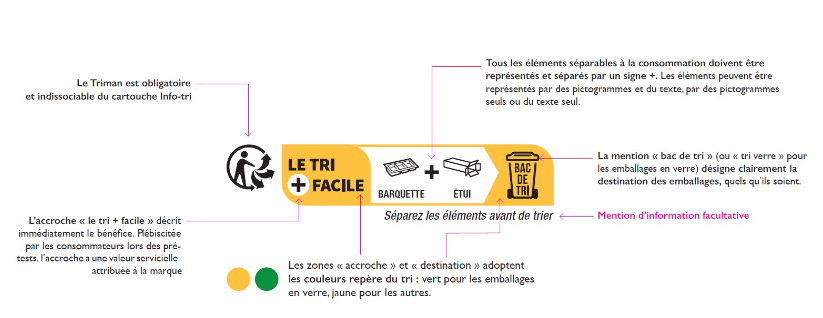
O logotipo Triman deve ser impresso a preto e branco (não a cores), com tamanho mínimo de 6 mm, não podendo ser sobreposto a outros elementos visuais ou ser menor que os símbolos impressos na sua imediação. As informações relativas ao material de embalagem e o processo de triagem devem ser apresentadas em francês (inclusive no e-commerce), pois esta é uma obrigação específica para o mercado francês.
A obrigação de cumprimento com a rotulagem ambiental em França é aplicável desde 1 de Janeiro de 2023. Foi concedido um período de transição até 9 de março de 2023, para embalagens produzidas ou importadas antes de 9 de setembro de 2022.
Referências:
1. Decreto Legislativo 3 settembre 2020, n. 116. Attuazione della direttiva (UE) 2018/851 che modifica la direttiva 2008/98/CE relativa ai rifiuti e attuazione della direttiva (UE) 2018/852 che modifica la direttiva 1994/62/CE sugli imballaggi e i rifiuti di imballaggio. (20G00135) (GU Serie Generale n.226 del 11-09-2020)
2. CONAI and Italian Institute of Packaging Guidelines. Available at: http://www.progettarericiclo.com/en/docs/environmental-labeling-packaging
3. LOI nº 2020-105 du 10 février 2020 relative à la lutte contre le gaspillage et à l’économie circulaire. Journal Officiel de La République Française. 11 février 2020
4. Ministére de la Tansition Écologique Et Solidaire – The Anti-Waste Law in the Daily Lives of the French People, What Does That Mean in Practice?















