DECRETO LEGISLATIVO Nº. 116
O Decreto Legislativo Italiano N.º 152 de abril de 2006 foi alterado pelo Decreto Legislativo N.º 116 de 3 de setembro de 2020. Este Decreto apresentou novos requisitos relativos à informação sobre eliminação que deve ser indicada na rotulagem dos produtos (incluindo produtos cosméticos e de cuidados pessoais, dispositivos médicos e suplementos alimentares). Essas obrigações aplicam-se aos fornecedores de materiais de embalagem, mas as empresas devem garantir a conformidade antes de disponibilizar os seus produtos no mecado.
O Decreto Legislativo N.º 116 (artigo 219, parágrafo 5º) afirma que “todas as embalagens devem ser devidamente rotuladas de acordo com os procedimentos estabelecidos pelas normas técnicas UNI aplicáveis e em conformidade com as decisões adoptadas pela Comissão da União Europeia, para facilitar a recolha , reaproveitamento, recuperação e reciclagem de embalagens, bem como disponibilizar aos consumidores informações corretas sobre o destino final ”. O decreto refere ainda que todos os fabricantes têm “a obrigação de indicar, para efeitos de identificação e classificação da embalagem, a natureza do material de embalagem utilizado, com base na Decisão da Comissão 97/129/CE”.
Em suma, isto significa que é obrigatório indicar claramente na rotulagem as seguintes informações: a natureza dos materiais de embalagem utilizados; as indicações quanto à recolha seletiva, reutilização, recuperação e reciclagem; e informações corretas aos consumidores sobre o destino final de embalagem.
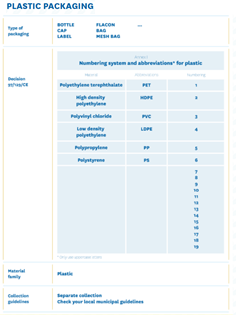
A exibição de informações sobre o descarte/eliminação é obrigatória nas embalagens que são fornecidas ao consumidor final (circuito B2C), não sendo exigida quando a embalagem se destina à atividade “profissional” (“pessoa física ou jurídica, ou seu intermediário , no exercício da sua actividade empresarial, comercial, artesanal ou profissional ”- circuito B2B) ou embalagem de transporte. Para embalagens B2B (e também B2C), é obrigatório figurar o código dos materiais que a compõem (de acordo com a Decisão 129/97/CE).
Os exemplos a seguir são sugeridos pela CONAI (consórcio privado nacional de embalagens) e pelo Instituto Italiano de Embalagem nas suas Guidelines emitidas sobre a rotulagem ambiental para empresas:
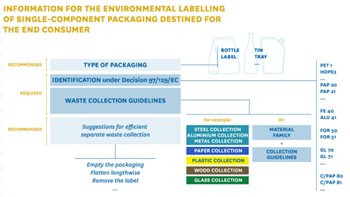
Isto aplica-se não só a embalagens constituídas por um único componente, mas também a embalagens de vários componentes (onde estes podem ser separados manualmente). É altamente recomendável que, para embalagens multicomponentes, os componentes individuais sejam identificados através de uma descrição escrita ou representação gráfica, que ajudará o consumidor a separá-los e descartá-los corretamente.
Devem ser adotados códigos de cores específicos, com vista a um reconhecimento visual instantâneo por parte dos consumidores:


Até 21 de dezembro de 2021, a obrigatoriedade de afixação da informação indicada no artigo 216.º, N.º 5 (eliminação de resíduos), encontra-se suspensa pelo Decreto-Lei N.º183 (31 de dezembro de 2020). No entanto, alguns artigos da legislação já são obrigatórios, como por exemplo a indicação da natureza do material de embalagem e dos códigos alfanuméricos (usados para identificar o tipo de material de embalagem).
Estes novos requisitos ambientais italianos podem ser um passo importante para a harmonização da rotulagem de eliminação de resíduos na União Europeia, assim como para uma melhor proteção do meio ambiente. Embora não seja obrigatório para outros países, pode ser uma vantagem para as empresas de cosméticos adotar estes requisitos e começar a adaptar os rótulos dos produtos.
Referências:
- Decreto Legislativo 3 settembre 2020, n. 116. Attuazione della direttiva (UE) 2018/851 che modifica la direttiva 2008/98/CE relativa ai rifiuti e attuazione della direttiva (UE) 2018/852 che modifica la direttiva 1994/62/CE sugli imballaggi e i rifiuti di imballaggio. (20G00135) (GU Serie Generale n.226 del 11-09-2020)
- Decreto Legislativo 3 aprile 2006, n. 152. Norme in materia ambientale. (GU Serie Generale n.88 del 14-04-2006 – Suppl. Ordinario n. 96)
- Decreto-Legge 31 dicembre 2020, n. 183. Disposizioni urgenti in materia di termini legislativi, di realizzazione di collegamenti digitali, di esecuzione della decisione (UE, EURATOM) 2020/2053 del Consiglio, del 14 dicembre 2020, nonche’ in materia di recesso del Regno Unito dall’Unione europea. (20G00206) (GU Serie Generale n.323 del 31-12-2020)
- CONAI and Italian Institute of Packaging Guidelines. Available from: http://www.progettarericiclo.com/en/docs/environmental-labeling-packaging















