IMPACTO NO QUOTIDIANO DOS CONSUMIDORES FRANCESES
Os plásticos de uso único são encontrados em todos os lugares do nosso quotidiano, inclusive em produtos cosméticos, pelo que se espera que a Lei Anti-Resíduos francesa tenha um grande impacto na vida e nos hábitos dos consumidores.
A Lei Anti-Resíduos francesa, também chamada de lei AGEC (Loi relative à la lute contre le gaspillage et a l’économie circulaire), contém cerca de 50 medidas que incluem novas obrigações (exigência de transparência), novas proibições (controlo de ambições ecológicas irreversíveis) e novas ferramentas para controlar melhor e sancionar infrações contra o meio ambiente. Estas terão um enorme impacto no modo de produção das empresas e no padrão de consumo dos cidadãos.
Eliminar o plástico descartável, informar melhor os consumidores, combater o desperdício e promover a reutilização, agir contra a obsolescência programada e produzir melhor são os principais pilares da lei AGEC.
A lei estabelece um método progressivo e fundamentado para a eliminação gradual, estabelecendo planos de 5 anos que determinarão metas de redução, reutilização e reciclagem de plástico. O objetivo principal é atingir zero plástico descartável até 2040 e essa proibição acontecerá em 4 etapas (2020-2025, 2025-2030, 2030-2035 e 2035-2040).
PRODUTOS COSMÉTICOS DISPONIBILIZADOS NO MERCADO FRANCÊS
Os produtos cosméticos que são disponibilizados no mercado francês também têm que cumprir a lei anti-resíduos.
Esta lei proíbe estritamente a destruição (aterro e incineração) de produtos não alimentares que não foram vendidos (o que inclui cosméticos) e as empresas serão agora obrigadas a dar-lhes um uso (por exemplo, doando-os a associações ou reciclando-os). No entanto, há uma exceção para produtos para os quais a reciclagem acarretaria um impacto ambiental negativo ou se for proibida (por apresentar risco ao meio ambiente ou à saúde humana) ou para os quais não exista solução técnica de reutilização, recuperação ou reciclagem.
Outra exigência regulamentar é que os consumidores sejam bem informados, inclusive sobre as características ambientais dos produtos. Neste sentido, o símbolo Triman é obrigatório e deve ser indicado no produto, na sua embalagem ou na documentação fornecida com o produto. Esta obrigação legal também é aplicável aos produtos vendidos online para França. Deve ser acompanhado das informações sobre o processo de triagem/separação para cada tipo de produto. Quaisquer outros sinais que possam confundir os consumidores em relação às regras de classificação devem ser removidos.
Este logotipo significa que os resíduos estão sujeitos a uma regra de separação e não significa necessariamente que os resíduos vão para o contentor de reciclagem (por exemplo, caixote do lixo amarelo para embalagens, devolução/recolha em loja para equipamentos eléctricos e electrónicos, estações de recolha de pilhas, etc.).
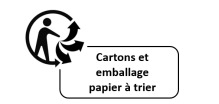
O logotipo Triman deve ser impresso a preto e branco (não a cores), com tamanho mínimo de 6 mm, não podendo ser sobreposto a outros elementos visuais ou ser menor que outros símbolos impressos. As informações relativas material de embalagem e o processo de triagem devem ser apresentadas em francês (inclusive no e-commerce), pois esta é uma obrigação específica para o mercado francês.
Foi concedido um período de transição até 9 de março de 2023, para embalagens produzidas ou importadas antes de 9 de setembro de 2022.
Referências:
1. LOI nº 2020-105 du 10 février 2020 relative à la lutte contre le gaspillage et à l’économie circulaire. Journal Officiel de La République Française. 11 février 2020.
2. Ministére de la Tansition Écologique Et Solidaire – The Anti-Waste Law in the Daily Lives of the French People, What Does That Mean in Practice?















