SALICILATO DE METILO
O Salicilato de Metilo (Methyl Salicylate, nome INCI: methyl 2-hydroxybenzoate) é o éster de álcool metílico e ácido salicílico. Em cosméticos e produtos de higiene pessoal, o Salicilato de Metilo é utilizado como desnaturante, aromatizante, higiene oral, agente perfumante e calmante. É utilizado como ingrediente em diversas misturas de fragrâncias e como aromatizante e calmante em produtos de higiene oral. O Salicilato de Metilo não se encontra atualmente incluído nos anexos do Regulamento Europeu de Cosméticos (nº 1223/2009), o que significa que o seu uso não tem restrições em produtos cosméticos. (ver publicação anterior)
O Salicilato de Metilo foi classificado como tóxico para a reprodução (substância CMR de categoria 2) sob o Regulamento CLP (Nº 1272/2008 relativo à classificação, rotulagem e embalagem de substâncias misturas). De acordo com o Regulamento de Cosméticos da UE, o uso de substâncias classificadas como CMR (cancerígenas, mutagénicas ou tóxicas para a reprodução) deve ser proibido em produtos cosméticos, a menos que, a excepcionalmente, condições específicas sejam cumpridas. Uma substância CMR classificada na categoria 2 poderá ser utilizada em produtos cosméticos se a mesma for avaliada pelo Comité Científico de Segurança dos Consumidores da Comissão Europeia (SCCS – Scientific Committee on Consumer Safety) e considerada segura para utilização em produtos cosméticos.
A Comissão Europeia solicitou ao SCCS que efetuasse uma avaliação da segurança do Salicilato de Metilo, tendo a mesma sido publicada em outubro de 2021. O SCCS concluiu que o Salicilato de Metilo é considerado seguro quando usado em cosméticos até à concentração máxima fornecida no dossiê apresentado. (ver publicação anterior)
NOTIFICAÇÃO DA COMISSÃO EUROPEIA À WTO
A 2 de maio, a Comissão Europeia notificou à Organização Mundial do Comércio (World Trade Organization – WTO) um projeto de regulamento que altera o Regulamento (CE) N.º 1223/2009 relativo aos produtos cosméticos.
Tendo em conta a classificação do Salicilato de Metilo como substância CMR de categoria 2 e o parecer emitido pelo SCCS, a Comissão considera que este ingrediente deve ser adicionado à lista de substâncias sujeitas a restrição em produtos cosméticos (Anexo III do Regulamento (CE) Nº 1223/2009).
É esperado que as restrições impostas à utilização de Salicilato de Metilo em produtos cosméticos esteja em concordância com as concentrações deste ingrediente consideradas seguras pelo SCCS nas diferentes categorias de produtos.
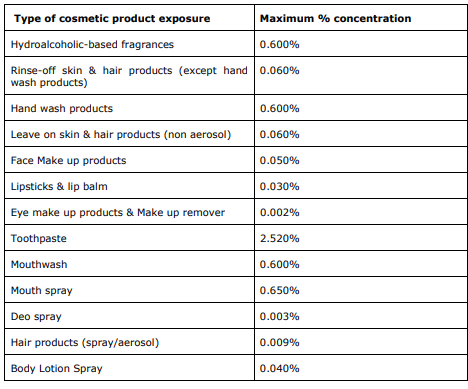
A alteração ao Anexo III do Regulamento será aplicável a partir de 17 de dezembro de 2022.
Espera-se que a partir de 17 de dezembro de 2022, as empresas não possam colocar produtos no mercado que não estejam em conformidade e que tenham que recolher os produtos não conformed que já estão disponíveis (nas prateleiras) no mercado da União Europeia.
Se desejar obter mais informações sobre a segurança de ingredientes cosméticos, não hesite em contatar-nos através de info@criticalcatalyst.com.
References:
- Regulation (EC) No 1223/2009 of the European Parliament and of the Council of 30 November 2009 on cosmetic products.
- Scientific Committee on Consumer Safety (SCCS). Opinion on Methyl salicylate (methyl 2-hydroxybenzoate). SCCS/1633/21. 2021
- Commission Delegated Regulation (EU) 2021/849 amending, for the purposes of its adaptation to technical and scientific progress, Part 3 of Annex VI to Regulation (EC) No 1272/2008 of the European Parliament and of the Council on classification, labelling and packaging of substances and mixtures















