O REGULAMENTO RELATIVO AOS DISPOSITIVOS MÉDICOS DA UE E O PROJETO CORE-MD
A União Europeia (UE) possui um setor de dispositivos médicos competitivo e inovador, com mais de 500.000 tipos de dispositivos médicos e dispositivos médicos in vitro colocados no mercado. O Regulamento de Dispositivos Médicos da UE (MDR – Medical Devices Regulation – Regulamento (UE) 2017/745) estabelece as regras relativas à colocação no mercado, disponibilização no mercado ou entrada em serviço de dispositivos médicos para uso humano (e acessórios desses mesmos dispositivos). O Regulamento (UE) 2017/746 estabelece as regras sobre dispositivos médicos para diagnóstico in vitro (IVDR – In Vitro Devices Regulation).
O MDR entrou em vigor no dia 26 de maio deste ano e, entre outros pontos, veio acompanhado de um aumento das exigências de evidências clínicas para dispositivos médicos de alto risco. Tal facto levantou algumas preocupações entre os fabricantes de dispositivos médicos, especialmente em relação a possíveis atrasos no acesso ao mercado e inovação. Na Europa, existem mais de 50% dos dispositivos médicos implantáveis classificados como de alto risco (por exemplo, válvulas cardíacas, próteses de anca, etc.) usados em cardiologia e ortopedia.
O Coordinating Research and Evidence for Medical Devices (CORE-MD) é um projeto do Horizon 2020 da União Europeia. A missão do CORE-MD é “traduzir o conhecimento especializado em aconselhamento para a orientação regulamentar da UE e desenvolver experiência em ciência regulamentar na comunidade clínica”. O CORE-MD “traduzirá evidências científicas e clínicas de especialistas em projetos de estudo para avaliação de dispositivos médicos de alto risco em conselhos para reguladores da UE, para alcançar um equilíbrio adequado entre inovação, segurança e eficácia“.
A Cardiologia e Ortopedia serão áreas de foco do CORE-MD. O projeto teve início em abril de 2021 e durará até março de 2024. É liderado pela Sociedade Europeia de Cardiologia (ESC – European Society of Cardiology), em estreita parceria com a Federação Europeia das Associações Nacionais de Ortopedia e Traumatologia (EFFORT – European Federation of National Associations of Orthopedics and Traumatology). O consórcio CORE-MD reúne associações médicas, reguladores da UE, institutos nacionais de saúde pública, órgãos notificados, instituições académicas, grupos de pacientes e agências de avaliação de tecnologias de saúde. As associações comerciais de fabricantes também participam. Este projeto envolve 35 associações médicas especializadas, que são membros da Biomedical Alliance na Europa.
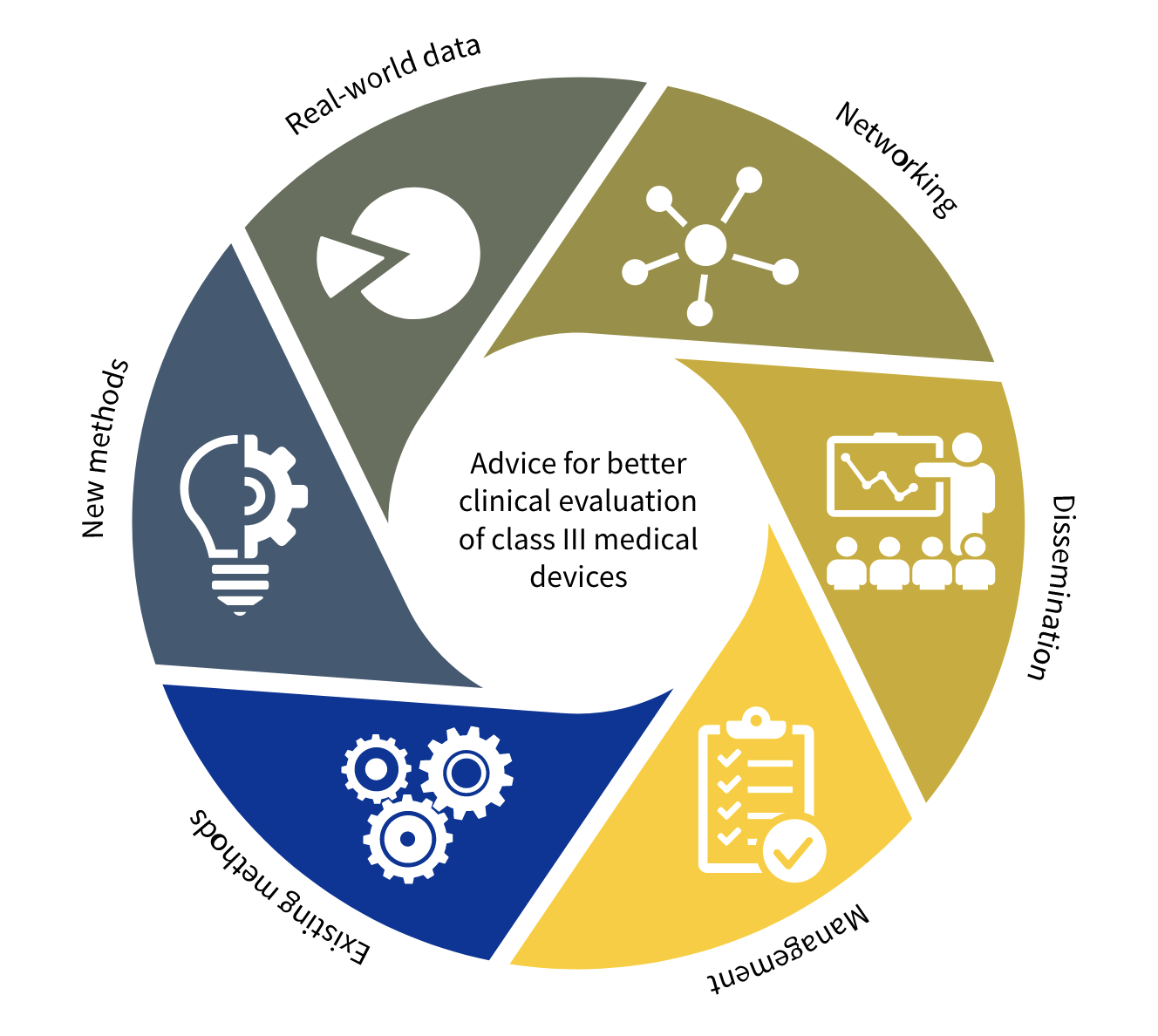
O projeto CORE-MD é composto por cinco Work Packages (WP).
O Work Package 1 irá rever e resumir os projetos de estudos que geraram evidências clínicas sobre o desempenho de dispositivos médicos de alto risco. Especificamente, irá reunir evidências sobre dispositivos de alto risco (classe III) implantados permanentemente nas áreas de cardiologia e ortopedia, bem como dispositivos de alto risco usados para o tratamento de diabetes mellitus. Os seus objetivos são:
- Realizar uma revisão sistemática das recomendações para a realização de investigações clínicas e ensaios de dispositivos médicos de alto risco, identificando sua concordância e discordância.
- Realizar uma revisão sistemática das metodologias de investigações clínicas que têm sido utilizadas para avaliar dispositivos médicos cardiovasculares, ortopédicos e diabéticos de alto risco, identificando problemas e classificando os desenhos dos estudos quanto à sua qualidade e adequação.
- Rever métodos estatísticos apropriados para avaliar estudos de dispositivos médicos de alto risco.
- Rever a utilidade das medições de resultados relatados pelo paciente e de experiência relatadas pelo paciente para gerar evidências clínicas pré e pós-mercado para dispositivos de alto risco, incluindo revisão independente de sua validade e precisão
O Work Package 2 avaliará como a evidência deve ser gerada para dispositivos médicos inovadores durante os primeiros estudos em humanos e os primeiros ensaios clínicos. Serão considerados novos métodos de geração de evidências e analisados os métodos de avaliação de dispositivos de alto risco para crianças. Será revista e desenvolvida orientação para a avaliação da inteligência artificial em dispositivos médicos e software autónomo como um dispositivo médico. Os seus objetivos são:
- Rever e recomendar designs alternativos de estudos clínicos que podem ser usados para fornecer evidências clínicas de alta qualidade para novos dispositivos médicos de alto risco.
- Conduzir estudos de viabilidade do uso da estrutura IDEAL nas fases iniciais de teste clínico do dispositivo.
- Pesquisar as orientações existentes e recomendar os critérios para a avaliação clínica e avaliação da conformidade regulamentar de inteligência artificial e machine learning em dispositivos médicos de alto risco.
- Rever e recomendar métodos de avaliação de dispositivos médicos de alto risco usados em crianças.
O Work Package 3 explorará métodos para obter e combinar as melhores evidências clínicas e científicas do mundo real sobre o desempenho clínico de dispositivos médicos de alto risco na prática diária (fase pós-marketing, por exemplo, de registos). Também investigará como os organismos notificados estão a aplicar as condições aos certificados de conformidade. Os seus objetivos são:
- Rever e desenvolver métodos para juntar dados clínicos de fontes e registos do mundo real ao longo do ciclo de vida de dispositivos médicos de alto risco.
- Desenvolver uma ferramenta baseada na web para a vigilância automatizada de relatórios relativos a tipos específicos de dispositivos médicos.
- Aconselhar a como deve ser gerada a evidência clínica pós-mercado, baseado numa análise das práticas dos organismos notificados na aplicação de condições aos certificados de conformidade.
O Work Package 4 proporcionará o forum para que todas as partes interessadas troquem/partilhem as melhores práticas e revejam coletivamente as evidências geradas, adotem documentos de posição e recomendações. Os seus objetivos são:
- Desenvolver um gráfico relativo à conduta ética relacionada com as investigações clínicas de dispositivos médicos inovadores de alto risco.
- Aprovar propostas do CORE – MD para uma hierarquia de níveis de evidência clínica para dispositivos médicos de alto risco.
- Recomendar como os sistemas regulamentares da UE podem implementar novas metodologias para investigações clínicas de dispositivos médicos de alto risco, usando evidências geradas ao longo de todo o seu ciclo de vida.
- Identificar as necessidades de formação de todas as partes interessadas para aprimorar seus conhecimentos em metodologias para a avaliação de dispositivos médicos de alto risco e desenvolver objetivos educacionais apropriados.
- Divulgar as publicações, recursos educacionais e resultados do CORE-MD o mais amplamente possível para a comunidade clínica e todas as partes interessadas através de boletins informativos, webinars e redes sociais.
O Work Package 5 coordenará e administrará o projeto em termos técnicos e administrativos.
Se deseja obter mais informações sobre o Regulamento de Dispositivos Médicos da UE (MDR – Regulamento (UE) 2017/745), não hesite em contatar-nos em info@criticalcatalyst.com.
Referências:
- Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02017R0745-20200424&from=EN
- Regulation (EU) 2017/746 of the European Parliament and of the Council of 5 April 2017 on in vitro diagnostic medical devices. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02017R0746-20170505&from=EN
- CORE-MD. Coordinating Research and Evidence for Medical Devices. About the initiative. Available from: https://www.core-md.eu/about-the-initiative/