Os dispositivos médicos ativos são classificados no âmbito do RDM pelas regras de classificação 9, 10, 11, 12 e 13. No entanto, as regras 9 e 10 só se aplicam a dispositivos médicos com finalidade médica prevista, e não podem ser aplicadas aos produtos ativos sem finalidade médica especificados no anexo XVI do RDM. Assim, esses produtos são classificados na classe I (de acordo com a regra 13) e o fabricante é obrigado a demonstrar conformidade com menos requisitos comparativamente aos dispositivos análogos com finalidade médica.
Alguns Estados-Membros solicitaram uma reclassificação de vários produtos sem finalidade médica, a fim de assegurar uma adequada avaliação da conformidade, coerente com os seus riscos inerentes.
Regulamento de Execução (UE) 2022/2347
No dia 2 de dezembro de 2022, a Comissão publicou o Regulamento de Execução (UE) 2022/2347 no Jornal Oficial da União Europeia, especificando as regras para a reclassificação destes produtos.
Os seguintes grupos de produtos ativos sem finalidade médica prevista enumerados no anexo XVI do RDM são reclassificados do seguinte modo:
| Secção do anexo XVI | Produto | Classificação anterior | Classificação atualizada |
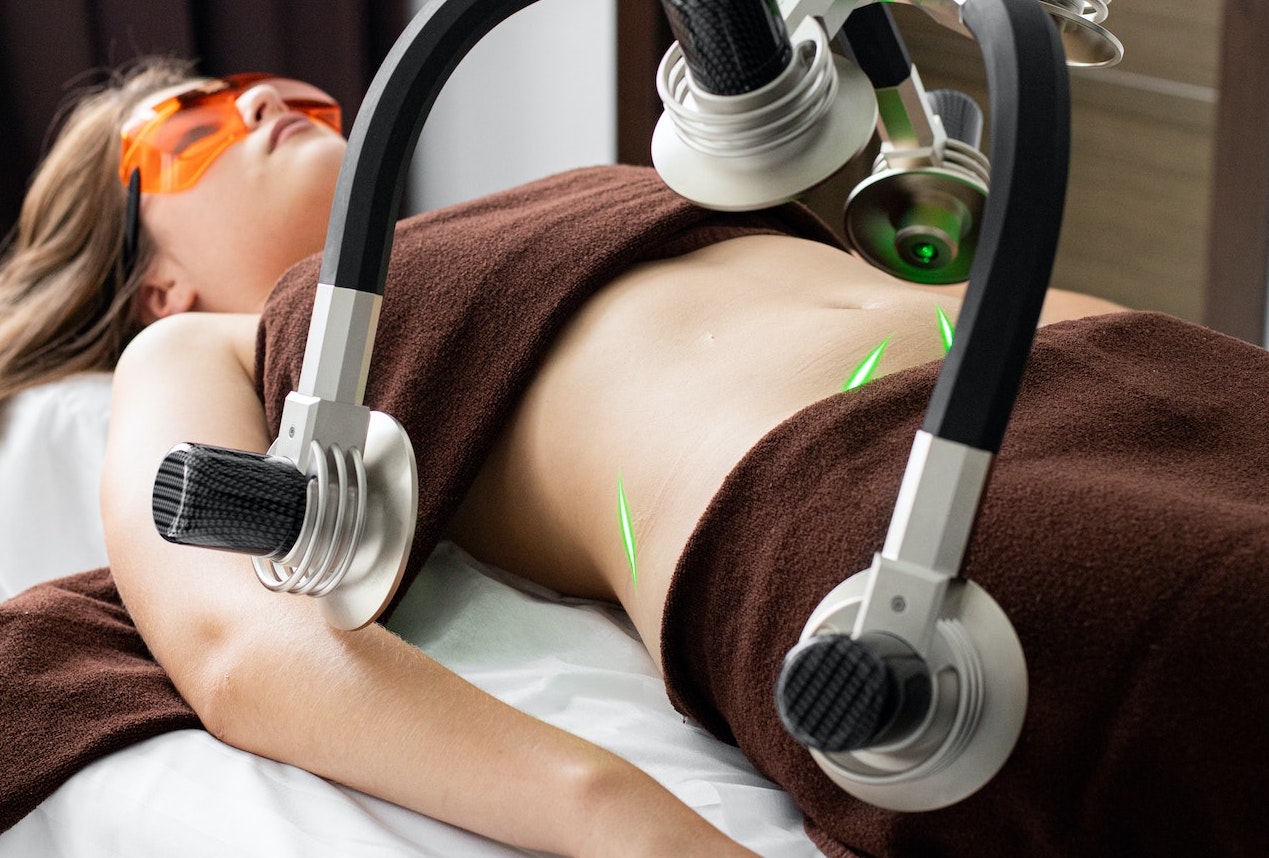
| Secção 4 | Equipamento destinado a ser utilizado para reduzir, eliminar ou destruir o tecido adiposo Ex.: Equipamento para lipoaspiração, lipólise por radiofrequências, lipólise por ultrassons, criolipólise, lipólise por raios laser, lipólise por infravermelhos e por estimulação elétrica, terapia por ondas de choque acústicas ou lipoplastia | Classe I | Classe IIb |
| Secção 5 | Equipamento emissor de radiações eletromagnéticas de alta intensidade destinado a ser utilizado para depilação. Ex.: Equipamento de raios laser e de luz intensa pulsada | Classe I | Classe IIa |
| Secção 5 | Equipamentos emissores de radiações eletromagnéticas de alta intensidade destinados ao tratamento de pele, renovação cutânea, remoção de cicatrizes, remoção de tatuagens ou para tratamento de nevus flammeus, hemangioma, telangiectasia e zonas de pele pigmentada. Ex.: Equipamento de raios laser e de luz intensa pulsada | Classe I | Classe IIb |
| Secção 6 | Equipamento para estimulação cerebral por aplicação de correntes elétricas ou de campos magnéticos ou eletromagnéticos que penetram no crânio a fim de alterar a atividade neuronal no cérebro. Ex.: equipamento destinado à estimulação magnética transcraniana ou à estimulação elétrica transcraniana | Classe I | Classe III |
O Regulamento de Execução (UE) 2022/2347 entra em vigor a 22 de dezembro de 2022, é obrigatório em todos os seus elementos e é diretamente aplicável em todos os Estados-Membros.
Para mais informações pode contactar-nos em info@criticalcatalyst.com.
Referências: