EL REGLAMENTOSOBRE LOS PRODUCTOS SANITARIOS DE LA UE Y EL PROYECTO CORE-MD
La Unión Europea (UE) tiene un sector de dispositivos médicos (productos sanitarios) competitivo e innovador con más de 500 000 tipos de dispositivos médicos y dispositivos médicos in vitro comercializados. El Reglamento sobre los productos sanitatios de la UE (MDR – Medical Devices Regulation – Reglamento (UE) 2017/745) establece normas relativas a la introducción en el mercado, la comercialización o la puesta en servicio de productos sanitarios para uso humano (y accesorios). El Reglamento (UE) 2017/746 establece las normas sobre productos sanitarios para diagnóstico in vitro (IVDR – In Vitro Devices Regulation).
El MDR entró en vigencia el 26 de mayo de este año y, entre otros puntos, hubo un aumento en los requisitos de evidencia clínica en productos sanitarios de alto riesgo. Esto ha suscitado algunas preocupaciones entre los fabricantes de productos sanitarios, en particular con respecto a posibles retrasos en el acceso al mercado y la innovación. En Europa, hay más del 50% de dispositivos médicos implantables clasificados como de alto riesgo (por ejemplo, válvulas cardíacas, reemplazos de cadera, etc.) utilizados en cardiología y ortopedia.
El Coordinating Research and Evidence for Medical Devices (CORE-MD) es un proyecto de la Unión Europea Horizon 2020. La misión de CORE-MD es “traducir el conocimiento experto en asesoramiento para la orientación regulatoria de la UE y desarrollar experiencia en ciencia regulatoria en la comunidad clínica”. El CORE-MD «traducirá la evidencia científica y clínica experta sobre diseños de estudios para evaluar productos sanitarios de alto riesgo en consejos para los reguladores de la UE, para lograr un equilibrio adecuado entre innovación, seguridad y eficacia«.
La Cardiología y Ortopedia serán áreas de enfoque del CORE-MD. El proyecto se inició en abril de 2021 y se extenderá hasta marzo de 2024. Está dirigido por la Sociedad Europea de Cardiología (ESC – European Society of Cardiology), en estrecha colaboración con la Federación Europea de Asociaciones Nacionales de Ortopedia y Traumatología (EFFORT – European Federation of National Associations of Orthopedics and Traumatology). El consorcio CORE-MD reúne a asociaciones médicas, reguladores de la UE, institutos nacionales de salud pública, organismos notificantes, instituciones académicas, grupos de pacientes y agencias de evaluación de tecnologías sanitarias. También participan las asociaciones comerciales de fabricantes. Este proyecto involucra a 35 asociaciones médicas especializadas, que son miembros de la Biomedical Alliance en Europa.
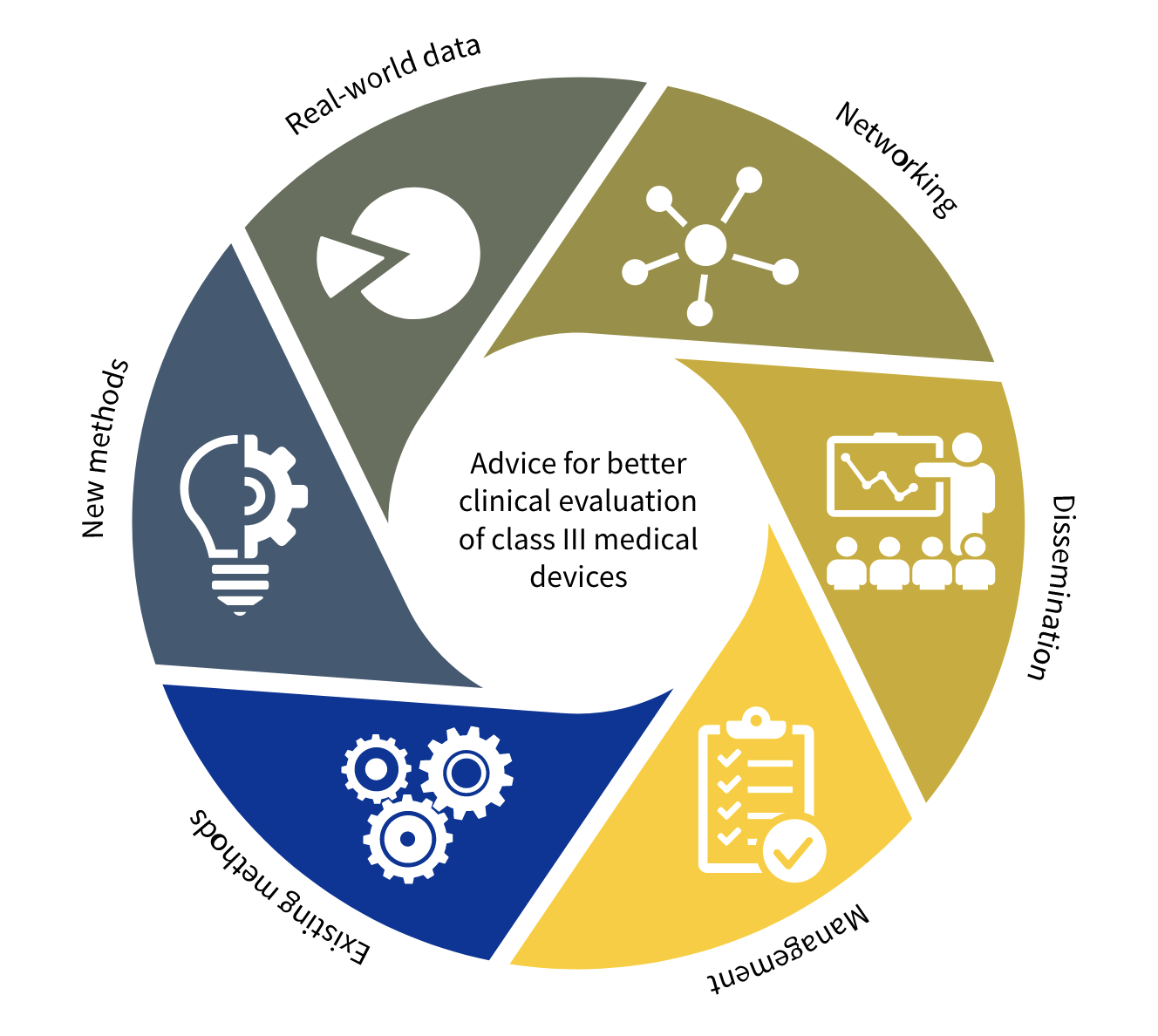
El proyecto CORE-MD está compuesto por cinco paquetes de trabajo (Work Packages – WP).
El Work Package 1 revisará y resumirá los diseños de los estudios que han generado evidencia clínica sobre el desempeño de los productos sanitarios de alto riesgo. En concreto, recogerá evidencias relativas a los productos implantados de forma permanente de alto riesgo (clase III) en los campos de la cardiología y la ortopedia, así como a los productos de alto riesgo utilizados para el tratamiento de la diabetes mellitus. Sus objetivos son:
- Realizar una revisión sistemática de recomendaciones para la realización de investigaciones clínicas y ensayos de productos sanitarios de alto riesgo, identificando su concordancia y discordancia.
- Realizar una revisión sistemática de las metodologías de investigaciones clínicas que se han utilizado para evaluar productos sanitarios cardiovasculares, ortopédicos y diabéticos de alto riesgo, identificando problemas y jerarquizando los diseños de estudios por su calidad y adecuación.
- Revisar métodos estadísticos apropiados para evaluar estudios de productos sanitarios de alto riesgo.
- Revisar la utilidad de las medidas de resultado informadas por el paciente y las medidas de experiencia informada por el paciente para generar evidencia clínica previa y posterior a la comercialización de productos de alto riesgo, incluida la revisión independiente de su validez y precisión.
El Work Package 2 evaluará cómo se debe generar evidencia para productos sanitarios inovadores durante los primeros estudios en humanos y los primeros ensayos clínicos. Se considerarán nuevos métodos de generación de evidencia y se analizarán métodos para evaluar productos de alto riesgo para niños. Se revisarán y desarrollarán directrices para la evaluación de la inteligencia artificial en productos sanitarios y software independiente como producto sanitatio. Sus objetivos son:
- Revisar y recomendar diseños alternativos de estudios clínicos que puedan usarse para proporcionar evidencia clínica de alta calidad para nuevos productos sanitarios de alto riesgo.
- Realizar estudios de viabilidad del uso del marco IDEAL en las primeras etapas de las pruebas clínicas del dispositivo.
- Estudiar la orientación existente y recomendar criterios para la evaluación clínica y la evaluación de la conformidad normativa de la inteligencia artificial y el machine learning (aprendizaje automático) en productos sanitarios de alto riesgo.
- Revisar y recomendar métodos para evaluar productos sanitarios de alto riesgo utilizados en niños.
El Work Package 3 explorará métodos para obtener y combinar las mejores pruebas clínicas y científicas del mundo real sobre el rendimiento clínico de los productos sanitarios de alto riesgo en la práctica diaria (fase posterior a la comercialización, por ejemplo, a partir de registros). También investigará cómo los organismos notificados están aplicando condiciones a los certificados de conformidad. Sus objetivos son:
- Revisar y desarrollar métodos para agregar datos clínicos de fuentes y registros del mundo real a lo largo del ciclo de vida de los productos sanitarios de alto riesgo.
- Desarrollar una herramienta basada en web para la vigilancia automatizada de informes relacionados con tipos específicos de productos sanitarios.
- Asesorar sobre cómo se deben generar las pruebas clínicas posteriores a la comercialización, basadas en un análisis de las prácticas de los organismos notificados en la aplicación de condiciones a los certificados de conformidad.
El Work Package 4 proporcionará el foro para que todas las partes interesadas intercambien las mejores prácticas y revisen colectivamente la evidencia generada, adopten documentos de posición y recomendaciones. Sus objetivos son:
- Desarrollar un cuadro para la conducta ética relacionada con las investigaciones clínicas de productos sanitarios innovadores de alto riesgo.
- Aprobar las propuestas de CORE – MD para una jerarquía de niveles de evidencia clínica para productos sanitarios de alto riesgo.
- Recomendar cómo los sistemas reguladores de la UE pueden implementar nuevas metodologías para las investigaciones clínicas de productos sanitarios de alto riesgo, utilizando evidencia generada a lo largo de todo su ciclo de vida.
- Identificar las necesidades de capacitación de todas las partes interesadas para mejorar su experiencia en metodologías para la evaluación de productos sanitarios de alto riesgo y desarrollar objetivos educativos apropiados.
- Difundir las publicaciones, los recursos educativos y los resultados de CORE-MD lo más ampliamente posible entre la comunidad clínica y todas las partes interesadas a través de boletines, webinars y redes sociales.
El Work Package 5 coordinará y administrará el proyecto en términos técnicos y administrativos.
Si desea obtener más información sobre el Reglamento sobre productos sanitarios de la UE (MDR – Reglamento (UE) 2017/745), no dude en contactarnos en info@criticalcatalyst.com.
Referencias:
- Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02017R0745-20200424&from=EN
- Regulation (EU) 2017/746 of the European Parliament and of the Council of 5 April 2017 on in vitro diagnostic medical devices. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02017R0746-20170505&from=EN
- CORE-MD. Coordinating Research and Evidence for Medical Devices. About the initiative. Available from: https://www.core-md.eu/about-the-initiative/